 届高考化学专题13 电化学综合应用Word下载.docx
届高考化学专题13 电化学综合应用Word下载.docx
- 文档编号:8340748
- 上传时间:2023-05-11
- 格式:DOCX
- 页数:17
- 大小:263.51KB
届高考化学专题13 电化学综合应用Word下载.docx
《届高考化学专题13 电化学综合应用Word下载.docx》由会员分享,可在线阅读,更多相关《届高考化学专题13 电化学综合应用Word下载.docx(17页珍藏版)》请在冰点文库上搜索。
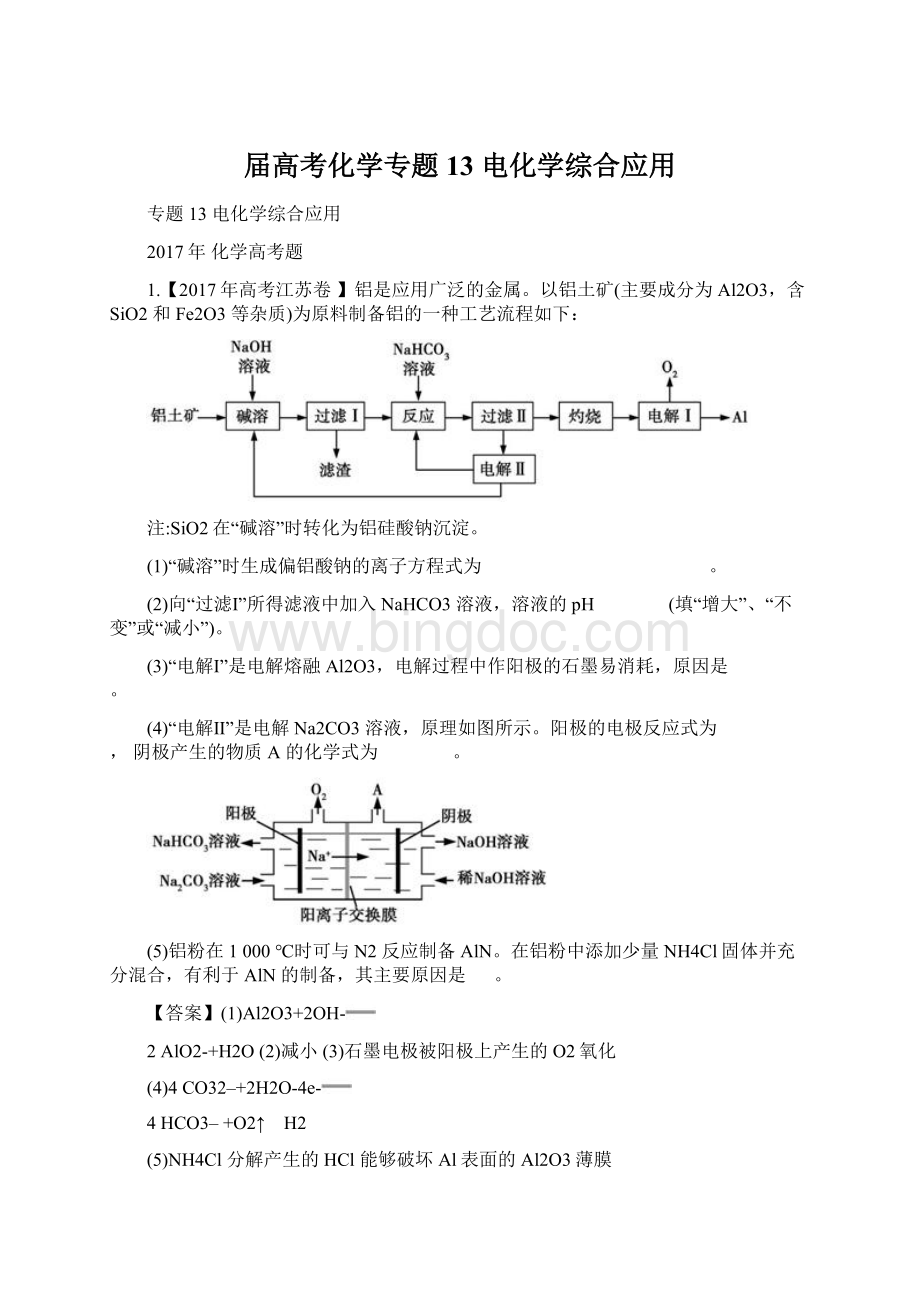
(1)反应①所加试剂NaOH的电子式为 ,B→C的反应条件为 ,C→Al的制备方法称为 。
(2)该小组探究反应②发生的条件。
D与浓盐酸混合,不加热,无变化;
加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。
由此判断影响该反应有效进行的因素有(填序号) 。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1molCl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·
xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42–能从浆液中分离出来的原因是 ,分离后含铬元素的粒子是 ;
阴极室生成的物质为 (写化学式)。
(1)
加热(或煅烧) 电解法
(2)ac
(3)2Cl2(g)+TiO2(s)+2C(s)
TiCl4(l)+2CO(g) ΔH=-85.6kJ·
mol-1
(4)在直流电场作用下,CrO42–通过阴离子交换膜向阳极室移动,脱离浆液 CrO42–和Cr2O72– NaOH和H2
【解析】本题考查化工流程分析、热化学方程式书写及电解原理等。
(1)NaOH由Na+和OH-构成,电子式为
。
根据题中图示转化关系,向溶液A中通入CO2,发生反应:
NaAlO2+2H2O+CO2
Al(OH)3↓+NaHCO3,沉淀B为Al(OH)3,固体C为Al2O3,B→C的反应条件为加热或煅烧,Al2O3→Al的制备方法为电解熔融氧化铝。
(2)根据“D与浓盐酸混合,不加热,无变化;
加热有Cl2生成”知温度对反应有影响;
滴加硫酸,引入H+,又产生Cl2,说明溶液的酸度对反应有影响。
(3)该还原性气体为CO,易水解生成TiO2·
xH2O的液态化合物为TiCl4,反应的化学方程式为2Cl2(g)+TiO2(s)+2C(s)
TiCl4(l)+2CO(g),结合题意知ΔH=-
×
2=-85.6kJ·
mol-1。
(4)题图2中电解分离装置采用离子交换膜,根据电解时阴离子向阳极移动,则在直流电场作用下,CrO42–通过阴离子膜向阳极室移动,脱离浆液。
在阳极室,CrO42–发生可逆反应:
2CrO42–+2H+
Cr2O72–+H2O,故分离后含铬元素的粒子是CrO42–、Cr2O72–。
在阴极室,H2O放电:
2H2O+2e-
H2↑+2OH-,c(OH-)增大,且Na+向阴极室移动,故阴极室生成的物质为NaOH、H2。
2016-2013年化学高考题
1.【2015上海化学】
(12分)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。
下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
(1)写出电解饱和食盐水的离子方程式。
(2)离子交换膜的作用为、。
(3)精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中位置流出。
(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式。
(5)室温下,0.1mol/LNaClO溶液的pH0.1mol/LNa2SO3溶液的pH。
(选填“大于”、“小于”或“等于”)。
浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为。
已知:
H2SO3Ki1=1.54×
10-2Ki2=1.02×
10-7
HClOKi1=2.95×
10-8
H
2CO3Ki1=4.3×
10-7Ki2=5.6×
10-11
(1)2Cl-+2H2O
Cl2↑+H2↑+2OH-
(2)阻止OH-进入阳极室,与Cl2发生副反应2NaOH+Cl2===NaCl+NaClO+H2O阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)ad
(4)2KClO3+H2C2O4+2H2SO4===2ClO2+2CO2+2KHSO4+2H2O
(5)大于SO32–>
CO32–>
HCO3–>
HSO3–
【解析】
(1)电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化反应。
产生Cl2。
反应的离子方程式是2Cl-+2H2O
Cl2↑+H2↑+2OH-。
(2)图中的离子交换膜只允许阳离子通过,不能使阴离子通过,这样阻止了OH—进入阳极室,阻止Cl—进入阴极室,使在阴极区产生的NaOH纯度更高。
同时可以阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)随着电解的进行,溶质NaCl不断消耗,所以应及时补充。
精制饱和食盐水从与阳极连接的图中a位置补充,由于阴极H+不断放电,附近的溶液显碱性,氢氧化钠溶液从图中d位置流出;
水不断被消耗,所以从b口不断加入蒸馏水,从c位置流出的是稀的NaCl溶液。
(4)KClO3有氧化性,H2C2O4有还原性,在酸性条件下KClO3可以和草酸(H2C2O4)生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
则根据电子守恒及原子守恒,可得该反应的化学方程式是:
2KClO3+H2C2O4+2H2SO4===2ClO2+2CO2+2KHSO4+2H2O。
(5)NaClO、Na2SO3都是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,破坏了水的电离平衡,当最终达到平衡时,溶液中c(OH-)>
c(H+),所以溶液显碱性。
形成盐的酸越弱,盐水解程度就越大。
消耗的离子浓度越大,当溶液达到平衡时,剩余的离子浓度就越小。
由于H2SO3的Ki2=1.02×
10-7;
HClO的Ki1=2.95×
10-8,所以酸性:
HSO3->
HClO,因此溶液的pH:
NaClO>
Na2SO3。
由于电离程度:
H2SO3>
H2CO3>
HCO3-,浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,水解程度:
SO32–,所以离子浓度:
SO32–>
CO32–;
水解产生的离子浓度:
HCO3->
HSO3-。
但是盐水解程度总的来说很小,主要以盐电离产生的离子存在。
所以在该溶液中SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为SO32–>
HSO3–。
【考点定位】考查电解原理的应用、氧化还原反应方程式的书写、电离平衡常数在比较离子浓度大小的应用的知识。
【名师点睛】氧化还原反应、电解原理、弱电解质的电离平衡理论、盐的水解、离子浓度大小比较是中学化学中的重要知识和理论,要掌握其反应原理、规律、方法、比较依据,再结合实际情况,进行正确的判断,得到相应的答案。
2.【2015北京理综化学】
(节选)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(4)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
结合方程式简述提取CO2的原理:
。
用该装置产生的物质处理b室排出的海水,合格后排回大海。
处理至合格的方法是。
(4)①a室:
2H2O-4e-===
O2↑+4H+,H+通过阳离子膜进入b室,发生反应:
HCO3-+H+===CO2↑+H2O。
②c室的反应:
2H2O+2e-===2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至接近装置入口海水的pH
(4)海水pH>8,显碱性,需要H+中和来降低海水的碱性,a室发生阳极反应:
O2↑+4H+,c(OH—)下降,水电离平衡右移,c(H+)增大,H+从a室进入b室,发生反应:
HCO3-+H+===CO2↑+H2O。
②
c室的反应:
【考点定位】考查化学平衡移动、电解等。
【名师点晴】本题以CO2在海洋中的转移和归宿为素材,考查有关化学反应原理知识,难度不大,要求学生掌握弱电解质的电离、化学方程式的书写以及利用守恒观点配平方程式,第(4)问利用电化学利用理论从海水中提取CO2,有利于减少环境温室气体含量,体现了化学与环境保护、理论与实际相结合的特点。
3.【2015北京理综化学】
(15分)为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I-
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。
实验如下:
(1)待实验
溶液颜色不再改变时,再进行实验
,目的是使实验
的反应达到。
(2)
是
的对比试验,目的是排除有
中造成的影响。
(3)
和
的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。
用化学平衡移动原理解释原因:
(4)根据氧化还原反应的规律,该同学推测
中Fe2+向Fe3+转化的原因:
外加Ag+使c(I—)降低,导致I-的还原性弱于Fe2+,用右图装置(a、b均为石墨电极)进行实验验证。
K闭合时,指针向右偏转,b作极。
当指针归零(反应达到平衡)后,向U型管左管滴加0.01mol/LAgNO3溶液,产生的现象证实了其推测,该现象是。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了
中Fe2+向Fe3+转化的原因,
转化原因是。
与(4)实验对比,不同的操作是。
(6)实验
中,还原性:
I—>
Fe2+;
而实验
Fe2+>
I—,将(3)和(4)、(5)作对比,得出的结论是。
【答案】
(1)化学平衡状态
(2)溶液稀释对颜色变化(3)加入Ag+发生反应:
Ag++I—===AgI↓,c(I—)降低;
或增大c(Fe2+)平衡均逆向移动(4)①正
②左管产生黄色沉淀,指针向左偏转
(5)①Fe2+随浓度增大,还原性增强
,使Fe2+还原性强于I-②向U型管右管中滴加1mol/L
FeSO4溶液(6)该反应为可逆氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动方向
的反应达到化学平衡状态。
(2)根据实验
和实验
的对比可以看出是为了排除有
中水造成溶液中离子浓度改变
的影响;
(3)i.加入AgNO3,Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3+
+
2I-
2Fe2+
I2平衡逆向移动。
ii.加入FeSO4,Fe2+浓度增大,平衡逆移。
(4)
K闭合时,指针向右偏转,b极为Fe3+得电子,作正极;
当指针归零(反应达到平衡)后,向U型管左管滴加0.01mol/LAgNO3溶液,产生黄色沉淀,I-离子浓度减小,2Fe3+
I2平衡左移,指针向左偏转。
(5)①Fe2+向Fe3+转化的原因是Fe2+浓度增大,还原性增强
;
②与(4)实验对比,不同的操作是当指针归零后,向U型管右管中滴加1mol/L
FeSO4溶液。
将(3)和(4)、(5)作对比,得出的结论是在其它条件不变时,物质的氧化性和还原性与浓度有关,浓度的改变可影响物质的氧化还原性,导致平衡移动。
【考点定位】考查化学平衡、电化学、以及化学实验设计等知识。
【名师点晴】本题以“2Fe3++2I-
2Fe2++I2”反应中Fe3+和Fe2+的相互转化为基本素材,考查化学平衡状态的判断、平衡的移动、原电池原理、化学实验设计等内容,要求学生在解答本题时能
充分接受、吸收、整合所给信息,分析和解决化学问题,同时本题第
(2)(5)等小问也体现了对化学实验与科学探究能力的考查。
题目难度不是很大。
解答本题时还要注意答题的规范性。
4.【2015海南化学】
(节选)银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。
回答下列问题。
(4)右图所示原电池正极的反应式为。
(4)Ag++e-===Ag
(4)该原电池的实质是Cu与银离子发生置换反应生成Ag单质,所以正极是生成Ag单质的还原反应。
【考点定位】本题考查金属的腐蚀、电极反应式的书写。
【名师点睛】以银及其化合物为载体考查原电池原理的应用。
考查学生分析问题、解决问题的能力。
5.【2015安徽理综化学】
(节选)C、N、O、Al、Si、Cu是常见的六种元素。
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。
(4)2H++NO3—+e—===NO2↑+H2O正Al在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应。
(4)正极得电子发生还原反应,故电极反应为:
2H++NO3—+e—===NO2↑+H2O;
在电场作用下,阳离子向电池正极移动,由图像得t1时刻电流方向改变,说明电负极发生改变,Al因为发生钝化不再进一步反应。
【考点定位】本题属于实验题,考查原电池原理等知识。
【名师点睛】判断原电池的正负极关键在于理解原电池的本质是氧化还原反应,根据这个原理来判断正负极,负极失电子,发生氧化反应,进而再根据电极材料、电解质溶液和题干信息书写电极反应式。
6.【2015重庆理综化学】
(节选)我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(5)如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是(填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为;
③若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为L(标准状况)。
【答案】(5)①c②2Cu2++3OH-+Cl-===Cu2(OH)3Cl↓③0.448
(5)①根据图示,青铜基体发生氧化反应,转化为Cu2+,故c作负极。
②负极上Cu发生氧化反应,产物为Cu2+,正极上O2发生还原反应,产物为OH-,故该反应为2Cu2++3OH-+Cl-===Cu2(OH)3Cl↓。
③根据得失电子守恒,由O2
4OH-、2Cu
Cu2(OH)3Cl,可得关系式:
O2~Cu2(OH)3Cl,则理论上消耗标准状况下O2的体积为0.02mol×
22.4L/mol=0.448L。
【考点定位】本题主要考查铜及其化合物的性质,电化学的基本原理。
【名师点晴】生活中常见的金属,以铜为载体设计题目的较少,试题背景注重化学与生活、社会、科技及历史等的有机结合和联系,突显了化学学科的特点,能较好的考查电化学基本知识。
7.【2015新课标Ⅱ卷理综化学】
(14分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
温度/℃
化合物
20
40
60
80
100
NH4Cl
29.3
37.2
45.8
55.3
65.6
77.3
ZnCl2
343
395
452
488
541
614
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp近似值
10-17
10-39
回答下列问题:
(1)该电池的正极反应式为,电池反应的离子方程式为。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zng。
(已经F=96500C/mol)
(3)废电池
糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过分离回收;
滤渣的主要成分是MnO2、______和,欲从中得到较纯的MnO2,最简便的方法是,其原理是。
(4)用废电池的锌皮制备ZnSO4·
7H2O的过程中,需去除少量杂质铁,其方法是:
加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为时,铁刚好完全沉淀(离子浓度小于1×
10-5mol/L时,即可认为该离子沉淀完全);
继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+
浓度为0.1mol/L)。
若上述过程不加H2O2后果是,原因是。
(1)MnO2+e—+H+===MnOOHZn+2MnO2+2H+===Zn2++2MnOOH
(2)0.05g
(3)加热浓缩、冷却结晶铁粉、MnOOH在空气中加热;
碳粉转变为CO2,MnOOH氧化为MnO2(4)Fe3+2.76Zn2+和Fe2+分离不开Fe(OH)2和Zn(OH)2的Ksp相近
(1)酸性锌锰干电池是一种一次电池,外壳为金属锌,锌是活泼的金属,锌是负极,电解质显酸性,则负极电极反应式为Zn—2e—===Zn2+。
中间是碳棒,碳棒是正极,其中二氧化锰得到电子转化为MnOOH,则正极电极反应式为MnO2+e—+H+===MnOOH,所以总反应式为Zn+2MnO2+2H+===Zn2++2MnOOH。
(2)维持电流强度为0.5A,电池工作五分钟,则通过的电量是0.5×
300=150,因此通过电子的物质的量是
,锌在反应中失去2个电子,则理论消耗Zn的质量是
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵。
根据表中数据可知氯化锌的溶解度受温度影响较大,因此两者可以通过结晶分离回收,即通过蒸发浓缩、冷却结晶实现分离。
二氧化锰、铁粉、MnOOH均难溶于水,因此滤渣的主要成分是二氧化锰、碳粉、MnOOH。
由于碳燃烧生成CO2,MnOOH能被氧化转化为二氧化锰,所以欲从中得到较纯的二氧化锰,最简便的方法是在空气中灼烧。
(4)双氧水具有强氧化性,能把铁氧化为铁离子,因此加入稀硫酸和双氧水,溶解后铁变为硫酸铁。
根据氢氧化铁的溶度积常数可知,当铁离子完全沉淀时溶液中铁离子浓度为10—5mol/L,则溶液中氢氧根的浓度=
,所以氢离子浓度是2×
10—3mol/L,pH=2.7,因此加碱调节pH为2.7时铁刚好完全沉淀。
Zn2+
浓度为0.1mol/L,根据氢氧化锌的溶度积常数可知开始沉淀时的氢氧根浓度为=
=10—8mol/L,氢离子浓度是10—6mol/L,pH=6,即继续加碱调节pH为6时锌开始沉淀。
如果不加双氧水,则铁与稀硫酸反应生成硫酸亚铁,由于氢氧化亚铁和氢氧化锌的溶度积常数接近,因此在沉淀锌离子的同时亚铁离子也沉淀,导致生成的氢氧化锌不纯,无法分离开Zn2+和Fe2+。
【考点定位】本题主要是考查原电池原理的应用、物质的分离与提纯等,涉及电极反应式书写、电解计算、溶度积常数的应用、pH计算、化学实验基本操作等。
【名师点晴】该题以酸性锌锰干电池为载体综合考查了氧化还原反应、电化学、化学计算、物质的分离与提纯等,能够很好地考查考生所掌握的化学知识结构。
考查了学生对知识理解、综合运用能力及阅读材料接受信息的能力和思维能力,对相关知识的掌握情况。
这道高考题为一道中高档题,能力要求较高。
8.【2014年高考海南卷】
(9分)锂锰电池的体积小、性能优良,是常用的一次电池。
该电池反应原理如图所示,其中电解质LiCIO4。
溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
(1)外电路的电流方向是由____极流向____极。
(填字母)
(2)电池正极反应式为。
(3)是否可用水代替电池中的混合有机溶剂?
____(填“是”或“否”),原因是____________。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。
K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
(1)ba
(2)MnO2+e-+Li+===LiMnO2(3)否电极Li是活泼金属,能与水反应
(4)3MnO2+KClO3+6KOH
2K2MnO4+KCl+3H2O2:
1
(1)结合所给装置图以及原电池反应原理,可知Li作负极材料,MnO2作正极材料,所以电子流向是从a→b,那么电流方向则是b→a;
(2)根据题目中的信息“电解质LiClO4溶于混合有机溶剂中,Li+
通过电解质迁移入MnO2晶格中,生成LiMnO2”,所以正极的电极反应式MnO2+e—+Li+===LiMnO2;
(3)因为负极的电极材料Li是活泼的金属,能够与水发生反应,故不能用水代替电池中的混合有机溶剂;
(4)由题目中的信息“MnO2可与KOH和KClO4在高温条件下反应,生成K2MnO4”,可知该反应属于氧化还原反应,Mn元素化合价升高,Cl元素的化合价降低,方程式:
3MnO2+KClO3+6KOH
2K2
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 届高考化学专题13 电化学综合应用 高考 化学 专题 13 电化学 综合 应用
 冰点文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰点文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《d t n l》公开课教案优秀教学设计5.docx
《d t n l》公开课教案优秀教学设计5.docx
